Качество воды из природных источников не всегда позволяет использовать ее в различных технологических процессах без предварительной водоподготовки. Например, могут не соответствовать техническим условиям показатели прозрачности из-за взвешенных веществ, высокая цветность и мутность. Присутствие различных химических примесей, включая соли жесткости, придают воде нежелательные органолептические свойства, и способствуют образованию плотного известкового осадка, который откладывается на внутренних поверхностях трубопроводов, нагревательных приборов и устройств. С целью удаления солей жесткости применяются различные способы умягчения.
Способы снижения жесткости
В арсенале средств водоподготовки выделяют ряд физических и физико-химических методов умягчения воды, включающих:
- температурное воздействие (нагревание, вымораживание или аквадистилляция);
- обработка специальными химическими реактивами;
- ионообменное умягчение воды;
- электромагнитный способ;
- обратный осмос;
- сочетание нескольких указанных способов.
Выбор методики и установки определяется исходными показателями качества воды (для этого необходимо провести исследование в специальной лаборатории), ее дальнейшим использованием, необходимой степенью водоочистки, а также техническими возможностями и экономической целесообразностью. Наиболее универсальным является метод ионного обмена, позволяющий довольно глубоко обрабатывать воду, очищая ее от солей жесткости, но при этом, не удаляя необходимые минеральные вещества.
Установки для умягчения методом ионного обмена
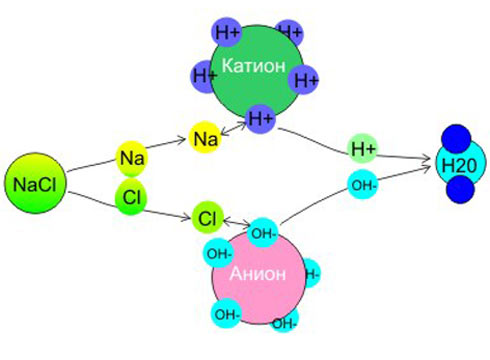
Основным компонентом такого устройства являются ионообменные смолы (иониты). Это так называемые сорбенты для ионного обмена, которые имеют вид очень плотного, водонерастворимого каркаса с положительным (+) или отрицательным (-) зарядом, а также компенсирующим его противоположно заряженным подвижным противоионом, который «захватывает» и обменивается с ионами одноименного заряда, растворенными в воде.
Каркас, или матрица незначительно набухает в водной среде. Ионообменные смолы подразделяют на несколько видов:
- По происхождению:
- природные (целлюлозные, древесные, торфяные)
- синтетические (из силикагеля, алюмогеля или сульфоугля).
- В зависимости от химической природы – иониты, выполненные из:
- неорганических веществ – цеолитов (щелочных и щелочноземельных алюмосиликатов),
- органических синтетических смол (стирол, акриламид и др.)
- минерально-органических веществ.
- По знаку заряда:
- Катиониты – это смолы, способные поглощать и замещать положительные ионы нежелательных примесей из водного раствора. В зависимости от «поглотителя» различают слабокислотные (содержат остаток карбоксильных кислот) и сильнокислотные (сульфокислотные группы);
- Аниониты – обеспечивают ионный обмен между отрицательно заряженными частицами раствора и ионита. Подразделяются на слабо-, средне- и сильноосновные;
- Амфолиты (амфотерные иониты) – одновременно выполняют роль и катионита, и анионита.
Эксплуатационные свойства катионитов определяются фракционным составов, т.е. размером зерен, а также способностью к набуханию и механической прочностью.
Механизм процесса умягчения воды методом ионного обмена
Удаление солей жесткости методом ионного обмена базируется на физико-химических особенностях ионитов, в результате чего они способны поглощать из воды ионы, заменяя их эквивалентным количеством ионов катионита такого же заряда. Проходя через слой ионообменника, процесс умягчения воды продолжается до определенной глубины катионита, заканчиваясь на уровне работающего слоя, называемого зоной умягчения.
При многократном использовании катионита верхний слой истощается и в нем образуется 3 зоны: истощения, рабочая и свежего катионита. Причем размер нерабочих слоев постепенно увеличивается, а зона умягчения сокращается и в момент достижения ее нижнего слоя катионита происходит «проскок» ионов жесткости – умягчение методом ионного обмена становится неэффективным.
Способы ионнообменного умягчения
В зависимости от того вида иона, которым «заряжен» катионит различают процессы:
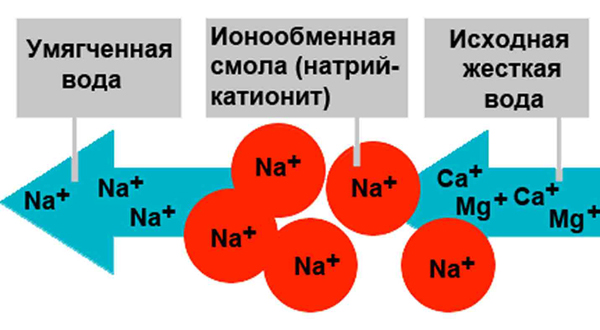
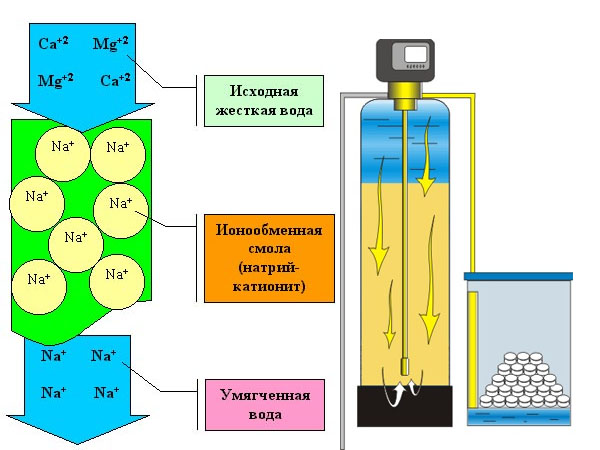
- натрий-катионирование (Nа+) осуществляется посредством прохождения через слой глауконита, сульфоугля или др. В результате соли кальция (Са2+) и магния (Mg2+), находящиеся в воде, вступают в реакции ионного обмена, замещая в фильтре натрий (Nа+)и образуя эквивалентное количество водорастворимых натриевых солей.

- водород-катионирование (Н+) – чаще применяют в сочетании с натрий-катионированием по одной из следующих схем:
- Последовательное катионирование путем пропуска воды вначале через водородный катионит. После перемешивания отфильтрованной и необработанной воды и прохождения ее через дегазатор (в нем удаляется углекислота) – она пропускается через натриевый катионит.
- Параллельный обмен с ионами Н+ (часть воды пропускается через водород-катионитный) Nа+ катионитного фильтра, через который проходит другая часть водного потока. После этого обе порции отфильтрованной водной среды смешиваются. В результате такого умягчения методом ионного обмена получают воду, характеризующуюся низкой жесткостью и невысокой щелочностью.
- Совместное катионирование – обработка осуществляется в одном фильтре-умягчителе, который содержит оба типа катионитов в разных слоях: верхний слой «работает» как водородный, а нижний — как натриевый катионит. При необходимости дополнительного умягчения обработанной воды методом ионного обмена используют натрий-катионитный фильтр второй ступени.
Эксплуатация ионнообменного умягчителя
Аппараты, используемые для умягчения воды методом ионного обмена, имеют конструкцию вертикального цилиндра. Его заполняют смолой-ионитом. Для устранения солей жесткости вода подается в верхнюю зону устройства, где она омывает слои смолы и постепенно освобождается от ионов жесткости. Так, по мере прохождения «сверху вниз» через ионообменную смолу концентрация Са2+ и Mg2+ постепенно уменьшается и снижается рН.
Для эффективной работы установки контролируют эти показатели и, если концентрация ионов жесткости и/или рН не снижаются – необходима регенерация смолы. Она включает взрыхление, собственно регенерацию соответствующим раствором и отмывку катионита от продуктов регенерации.
Принцип физико-химических процессов, характерных для ионного обмена показан на видео